По номеру периода можно определить: Что можно определить по номеру периода, группы? Расставить элементы в порядке возрастания
По номеру периода определяют число электронных уровней в атоме. — Студопедия
МАТЕРИАЛЫ ДЛЯ ПОВТОРЕНИЯ.
I.СТРОЕНИЕ АТОМОВ ПЕРВЫХ ДВАДЦАТИ ЭЛЕМЕНТОВ ПЕРИОДИЧЕСКОЙ ТАБЛИЦЫ, ИЗМЕНЕНИЕ СВОЙСТВ ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ
НЕОБХОДИМО ЗНАТЬ:
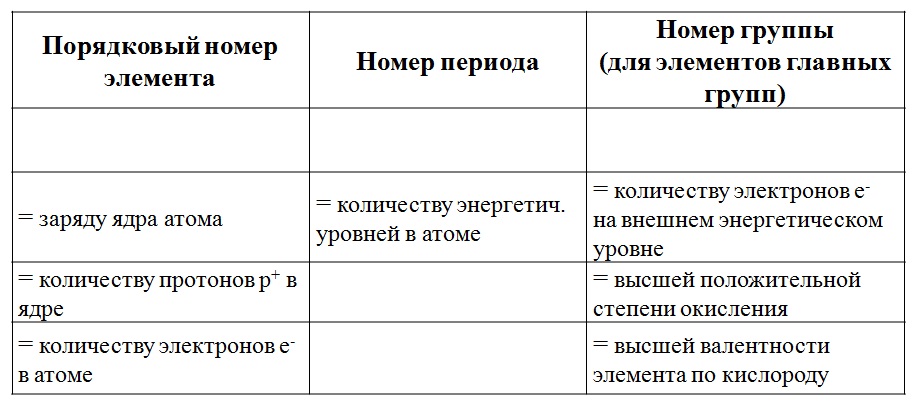
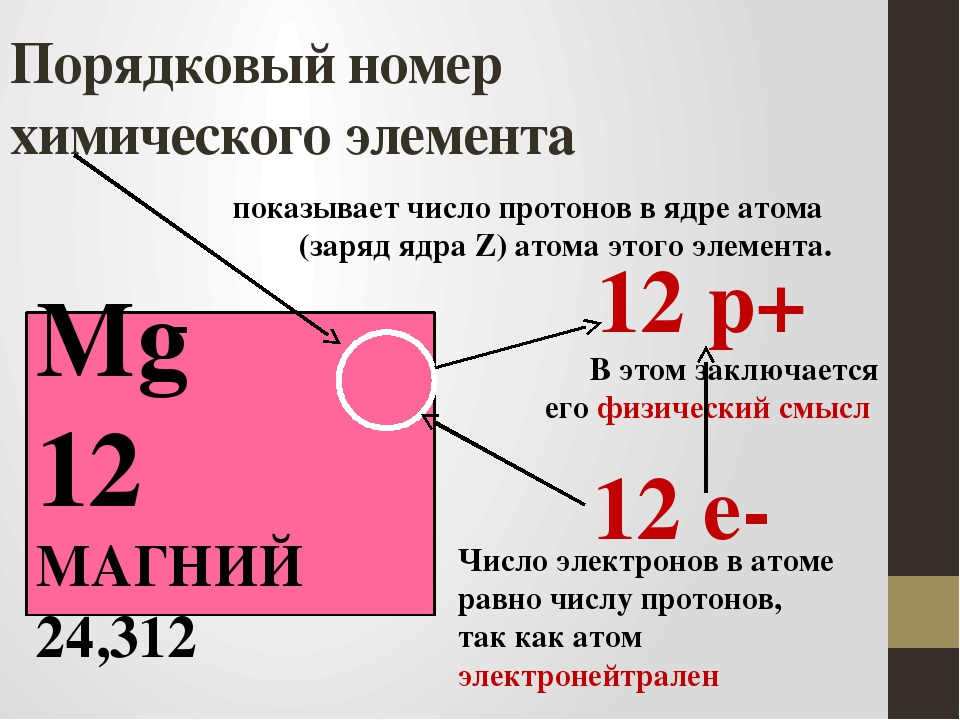
1. По порядковому номеру элемента можно определить:
а) заряд ядра;
б) число протонов;
в) число электронов;
г) рассчитать число нейтронов (от относительной атомной массы отнять число протонов).
По номеру периода определяют число электронных уровней в атоме.
3. По номеру группы можно определить:
а) число электронов на внешнем уровне для элементов
главной (А) подгруппы;
б) максимальную валентность (есть исключения).
4. Слева направо по периоду:
а) металлические свойства простых веществ, образованных элементами, уменьшаются, а неметаллические свойства увеличиваются;
б) радиус атома уменьшается;
в) основные свойства оксидов и гидроксидов уменьшаются, а кислотные свойства увеличиваются;
г) восстановительные свойства уменьшаются, а окисли-
тельные увеличиваются;
д) электроотрицательность элементов возрастает.
5. Сверху вниз по группе:
а) металлические свойства простых веществ, образованных элементами, увеличиваются, а неметаллические свойства убывают;
б) радиус атома увеличивается;
в) основные свойства оксидов и гидроксидов возрастают, а кислотные свойства убывают;
г) электроотрицательность элементов уменьшается.
6. Изотопы — это атомы, имеющие одинаковый заряд
ядра, одинаковое число протонов, но разное число нейтронов и поэтому разную относительную атомную массу.
7. Химический элемент — это вид атомов с одинаковым зарядом ядра, т.е. совокупность изотопов.
8. Атомы металлов, как правило, имеют на внешнем уровне 1 , 2 , 3 электрона и большой атомный радиус. Атомы неметаллов имеют четыре и более электронов на внешнем
уровне.
9. Слева направо по периоду идет увеличение числа
электронов на внешнем уровне и максимальная валентность ( или степень окисления) элементов увеличивается.
10. При переходе от одного периода к другому появляется новый уровень и происходит резкий переход свойств веществ от инертного газа к щелочному металлу.
5. Правила определения электроотрицательности по периодической таблице:
а) слева направо по периоду и снизу вверх по группе электроотрицательность атомов увеличивается;
б) самый электроотрицательный элемент — фтор, так как инертные газы имеют завершенный внешний уровень и не стремятся отдавать или принимать электроны;
в) атомы неметаллов всегда более электроотрицательны, чем атомы металлов;
г) водород имеет низкую электроотрицательность, хотя расположен в верхней части периодической таблицы.
2задание: Напишите полную электронную формулу и нарисуйте орбитальную диаграмму ( простейшую формулу строения атома) для элемента 19K.
3 задание: Назовите элементы и укажите число неспаренных электронов в атомах, имеющих следующие электронные конфигурации:
а) 1s2 2s2 2p6 3s2 3p2; б) 1s2 2s2 2p6 3s2 3p4;
ВЫБЕРИ НЕСКОЛЬКО ПРАВИЛЬНЫХ ОТВЕТОВ
1. В ряду элементов Na —» Mg —» А1 —» Si
В ряду элементов Na —» Mg —» А1 —» Si
1) металлические свойства усиливаются
2) неметаллические свойства усиливаются
3) свойства не изменяются
4) металлические и неметаллические свойства изменя-
Число нейтронов в атоме. Изотопы — урок. Химия, 8–9 класс.
Число нейтронов в атоме
Мы знаем, что масса атома определяется массой ядра. Ядро состоит из протонов и нейтронов, относительные массы которых равны \(1\). Масса ядра равна сумме масс протонов и нейтронов. Число протонов определяем по порядковому номеру элемента. Значит, число нейтронов в ядре можно найти, если от относительной атомной массы отнять порядковый номер.
Пример:
фтор — элемент № \(9\). Его относительная атомная масса равна \(19\).
В ядре атома фтора — \(9\) протонов и \(19\) \(–\) \(9\) \(=\) \(10\) нейтронов.
Рубидий — элемент № \(37\). Его относительная атомная масса равна \(85\).
В ядре атома рубидия — \(37\) протонов и \(85\) \(–\) \(37\) \(=\) \(48\) нейтронов.
Нуклиды
Вид атомов с определённым числом протонов и нейтронов в ядре называется нуклидом.
Нуклид обозначается следующим образом: внизу слева записывается число протонов \(Z\) (порядковый номер), вверху слева указывается массовое число \(A\) (сумма чисел протонов и нейтронов) — RZA, например: C612, Se3479.
Для обозначения нуклидов используют и другие способы записи:
углерод — \(12\), C — \(12\), C12;
селен — \(79\), Se — \(79\), Se79.
Изотопы
Атомы одного и того же химического элемента могут иметь разные массы. Существуют атомы водорода с массами \(1\), \(2\) и \(3\), атомы хлора с массами \(35\) и \(37\) и т. д.
Разновидности атомов одного химического элемента, имеющие разные атомные массы, называют изотопами.
С учётом знаний о строении ядра это определение можно сформулировать по-другому.
Изотопы — разновидности атомов с одинаковым числом протонов в ядре (зарядом ядра), но разным числом нейтронов.
Значит, изотопы отличаются только числом нейтронов.
Протоны определяют свойства атома, то есть придают ему индивидуальность. А нейтроны не влияют на свойства атома, а отражаются на его массе. Поэтому все изотопы одного и того же элемента химически неотличимы.
Химический элемент — это вид атомов с определённым зарядом ядра.
Относительная атомная масса элемента
Большинство химических элементов существуют в виде смеси изотопов. Приведённая в Периодической таблице относительная атомная масса элемента — это средняя величина атомных масс всех его изотопов.
Пример:
определим относительную атомную массу хлора. \(25\) % его атомов — это атомы с массой \(37\), а \(75\) % — с массой \(35\).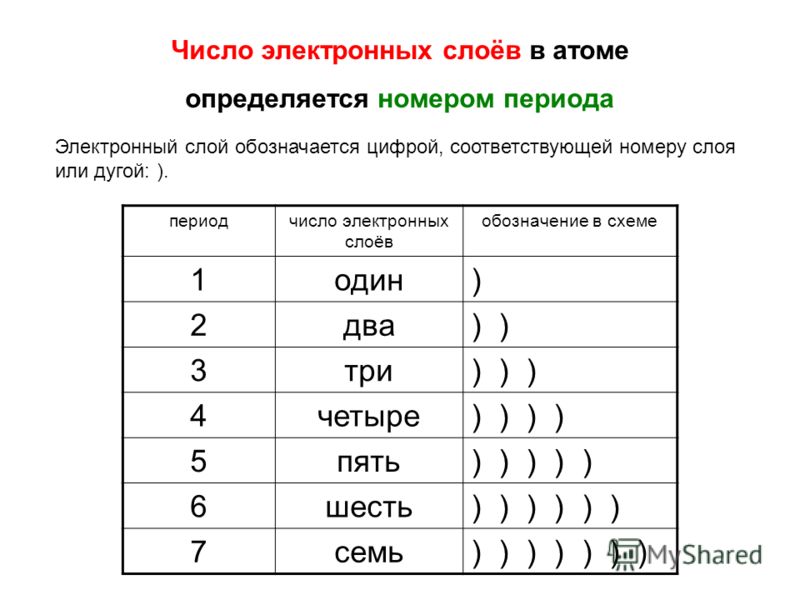 Найдём среднее значение:
Найдём среднее значение:
Ar(Cl)=(37
·25+35
·75)100 \(=\) 35,5.
Строение атома
Атом — это наименьшая частица химического элемента, сохраняющая все его химические свойства. Атом состоит из ядра и вращающихся вокруг него электронов. Ядро также имеет сложное строение и состоит из нейтронов и электронов.
Число электронов равно числу протонов в атоме и определяется порядковым номером. В связи с этим атом в целом электронейтрален, так как электроны заряжены отрицательно, а протоны положительно. Заряд ядра также равен порядковому номеру. Число нейтронов рассчитывается по формуле N = A — Z, где N — общее число нейтронов, А — массовое число, Z — заряд ядра. Число энергетических уровней в атоме определяется номером периода. Число электронов на последнем внешнем уровне равно номеру группы.
Максимальное число электронов на энергетическом уровне определяется формулой N = 2 * n^2 , где N — общее число электронов на энергетическом уровне, n — номер уровня. 2) и т.д.
2) и т.д.
Каждый энергетический уровень делится на подуровни. На первом уровне только один подуровень — s. На втором уровне два подуровня — s и p. на третьем — s, p и d. На четвертом — s, p, d и f.
Максимальное число электронов на подуровнях
- 2 — максимальное число электронов на s-подуровне.
- 6 — максимальное число электронов на p-подуровне.
- 10 — максимальное число электронов на d-подуровне.
- 14 — максимальное число электронов на f-подуровне.
Максимальное число электронов на подуровне не зависит от номера уровня.
Заполнение энергетических уровней
1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f < 5d < 6p < 7s
Геометрия орбиталей
Примеры
Полезные ссылки
Источник материала
Электронная оболочка атома (видео)
Строение атома (Часть 1) (видео)
Строение атома (Часть 2) (видео)
Строение атома. Ядерные силы (видео)
Ядерные силы (видео)
Дополнительные материалы
Модели строения атома (видео)
Строение атома: Атомное ядро (видео)
Химия. Строение атома: Строение электронных оболочек (видео)
Строение атома (видео)
Все, что можно узнать о вас в Telegram-ботах
28 Мая, 2020,
15:01
18308
Скандал вокруг сохранности персональных данных разразился в мае: в Telegram засветились каналы/боты (раз и два), в которых можно было приобрести персональные данные украинцев. Эти каналы и боты быстро закрыли, однако, проблема шире и дело этим не заканчивается.
Эти каналы и боты быстро закрыли, однако, проблема шире и дело этим не заканчивается.
Артем Старосек, CEO ресерч-компании Molfar, в колонке для AIN.UA рассказывает о возможностях Telegram-ботов в поиске персональных данных.
Я изучил 12 ботов, в которых содержится информация о украинцах. Часть из них разрабатывается в Украине и работает только с открытыми данными, по части — собственники неизвестны, у третьих — оплата только в рублях или через русские пеймент-процессоры.
В большинстве сервисов буду проверять информацию о себе. На входе использую только ФИО.
Боты и что они показывают
@info_baza_bot (Info_baza) — ищет человека в Украине по ФИО, фото, номеру телефона, водительским правам либо email. База содержит 420 000 пользователей, 70 млн номеров и 20 млн украинских email-адресов.
Первые 7 результатов поиска — бесплатные. VIP-пакеты (стоимостью $15 — $50 в год) предоставляют безлимитный поиск. Также VIP-доступ можно получить, пригласив как минимум 50 друзей. Не думаю, что друзья будут рады по неосторожности попасть в эту базу данных. В платном пакете, за $10 доступны паспортные данные и ИНН.
Не думаю, что друзья будут рады по неосторожности попасть в эту базу данных. В платном пакете, за $10 доступны паспортные данные и ИНН.
Вбиваю ФИО и получаю дату рождения, почту, мобильный и городской телефоны, а также вариации, как я подписан в базах. Отчасти, те же функции у @get_kontakt_bot (get_contact) — поиск владельца по номеру телефона. Бот бесплатен, но принимает донаты на Qiwi, Paypal, WM, Yandex.Money.
@Smart_SearchBot (SmartSearchBot) — альтернатива info_baza. По почте отдает телефон, ФИО и дату рождения. Стоимость варьируется от $0,9 за сутки до $30 за год. Оплата только на Qiwi. Ищем дальше по найденной в Info_baza, gmail-почте и получаем еще одну старую почту и профиль «ВКонтакте».
@get_caller_bot (GetCaller) — альтернатива @Info_baza и @SmartSearchBot. Ищет только по номеру телефона. На выходе: ФИО, дата рождения, почта и «ВКонтакте». Полезен расширенным количеством внешних баз: «Приватбанк», «Ощадбанк», Нова Пошта. В остальном, содержит информацию из ряда взломанных форумов, фриланс-досок и магазинов из РФ.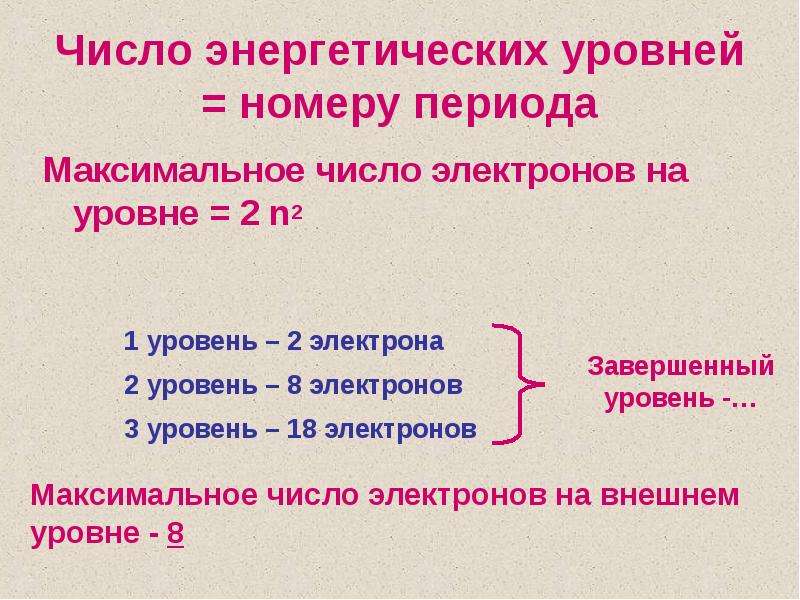
@Dosie_Bot («Досье») — создатели «Досье» пошли дальше и по номеру телефона отдают ИНН и номер паспорта. В пакете «Максимальный» стоимость запроса варьируется от 9 до 15 грн, в зависимости от срока подписки. Оплата на виртуальную анонимную карту «Индустриалбанка» или «BTC».
@UAFind_bot (UAFindbot) — логическое дополнение бота «Досье». Ищет ФИО по ИНН или адресу и наоборот. 2 запроса бесплатно, дальше безлимит за 500 грн. Прием платежа в рублях через русский пеймент-процессор free-kassa.ru.
@OpenDataUABot (OpenDataUA) — по коду ЕДРПОУ возвращает данные о компании из реестра, по ФИО — наличие регистрации ФОП. Есть мониторинг появления судебных дел по ФИО. По ИНН находит адрес недвижимости; за 30 грн доступна подробная выписка из реестра. По номеру авто доступны характеристики машины, проверка когда машина была зарегистрирована, другие транспортные средства владельца, другие машины, которым был присвоен этот номер за последние 5 лет. По номеру паспорта проверка в базах потерянных и аннулированных паспортов. Узнав ИНН из бота Досье, через Opendatabot узнаю: я — ФОП и у меня есть недвижимость.
Узнав ИНН из бота Досье, через Opendatabot узнаю: я — ФОП и у меня есть недвижимость.
@mailsearchbot (Mailsearch_bot) — поиск по базам данных взломанных паролей. По почте отдает пароль, часть которого закрыта звездочками. Если вам этого мало, есть еще @Shiverbot, который отдает пароль плейнтекстом.
@last4mailbot (Mail2Phone) — по почте показывает статус: есть ли аккаунт в «Одноклассниках» и «Сбербанке», или нет.
@VKUserInfo_bot — по ID «ВКонтакте» возвращает расширенную информацию о профиле.
@GetGmail_bot (GetGmail — OSINT email search) — по gmail-почте отдает Google ID, зная который, можно получить архив альбомов Google, а также редактирования и отзывы на Google-картах. Последнее укажет на геолокацию: странно, если человек представился жителем Брюгге, но оставляет отзывы о булочных в Кривом Рогу.
@telesint_bot (TeleSINT) — информация об участии пользователей Telegram в открытых и закрытых группах. Поиск — по нику.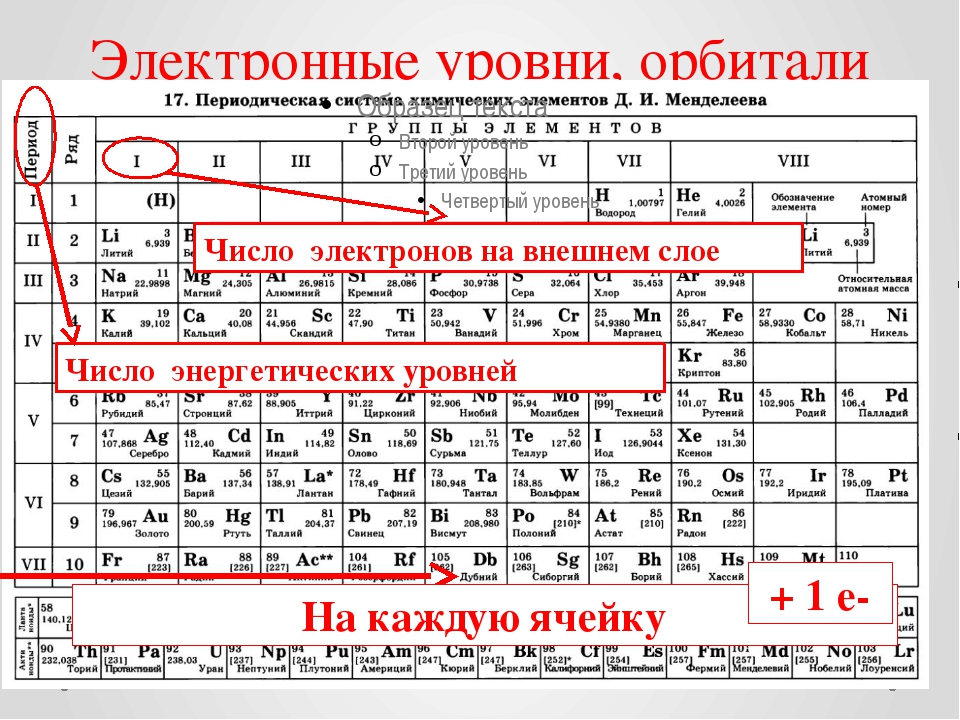
В итоге, зная только ФИО человека на старте, финишируем с:
- дата рождения;
- телефоны;
- почты;
- номер паспорта;
- ИНН;
- недвижимость;
- наличие ФОП;
- пароли к почте;
- профили «ВКонтакте» и «Одноклассники»;
- геолокация и группы в Telegram.
Если лень запоминать и добавлять все бота, можно воспользоваться ботом @HowToFind_UA_bot (HowToFind Ukrainian Bot). В нем можно выбирать из списка информацию, которая известна, и бот покажет боты или ресурсы, которые помогут обработать информацию.
Автор: Артем Старосек, CEO ресерч-компании Molfar
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Таблица степеней окисления химических элементов. Возможные степени окисления химических элементов. Стандартные, высшие, низшие, редкие степени окисления, исключения. Максимальная степень окисления и минимальная степень окисления.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
App Store: Где мои дети: GPS трекер
«Где мои дети» создано специально для заботливых родителей. Приложение позволит отслеживать местоположение ребенка online, покажет уровень его активности за день и статистику использования приложений на его телефоне.
Приложение позволит отслеживать местоположение ребенка online, покажет уровень его активности за день и статистику использования приложений на его телефоне.
Вы также будете получать уведомления:
— о входе/выходе ребенка из дома и других мест, созданных Вами;
— при низком заряде его телефона
— если ребенок нажал «тревожную кнопку»
Для работы сервиса Вам необходимо установить приложение «Где мои дети» на свой телефон и приложение Pingo! на телефон ребенка. Либо подключить GPS-часы или гаджет, доступные Вам в нашем магазине.
Данные о ребенке обновляются каждые 15 минут, но Вы можете запросить их в любой момент, когда потребуется, используя функцию «обновить». Если телефон ребенка перестал посылать данные, приложение уведомит Вас об этом и подскажет возможные причины.
Список поддерживаемых моделей:
Q50, Q60, Q60s, Gw900, Gw900s,Q70, Q75, Q80, Gw100, Q90, Q100, Q200, Q360, Q1000, Q1000s, Gw100s, Gw200s, Gw300, Gw300s, Gw400s, Gw1000, Ew100, Ew200,
Gw700, T58, Smart Pet Tracker (все возможные варианты модели), Ew100s, Gw500s, L70, L70s, G10, G100, W8, W9, S1, D99, D100, PT01, Aimoto, Aimoto Start, Aimoto Sport, Aimoto Ocean, и многие другие аналогичные.
Вы можете использовать все функции сервиса бесплатно, в течение 7 дней после первого запуска приложения. По окончании этого периода, в бесплатной версии Вам будет доступна функция определения местоположения online. Для доступа ко всем функциям приложения необходимо купить подписку.
Стоимость подписки будет списана с Вашего счета, указанного в App Store. Ваша подписка будет автоматически продлеваться с периодичностью, согласно выбранному варианту, если не будет отменена Вами ранее чем за 24 часа до окончания текущего периода. Вы не сможете отказаться от подписки после её приобретения. Управление подпиской доступно в настройках Вашего аккаунта App Store после покупки.
Запрашиваемый доступ:
— к камере и фото — для установки аватара при регистрации ребенка
— к контактам — в случае настройки GPS-часов (выбрать номера из контактов)
— к геопозиции, в т.ч в фоновом режиме — для определения местоположения ребенка
— к микрофону — для отправки голосовых сообщений в чат
— push уведомлениям — для отправки уведомлений чата
Ознакомиться с Пользовательским соглашением вы можете по ссылке: https://findmykids. org/docs/terms-of-use/
org/docs/terms-of-use/
Политика конфиденциальности: https://findmykids.org/docs/privacy-policy/
По всем предложениям и вопросам к работе нашего приложения пишите [email protected] или на сайте http://findmykids.org/faq
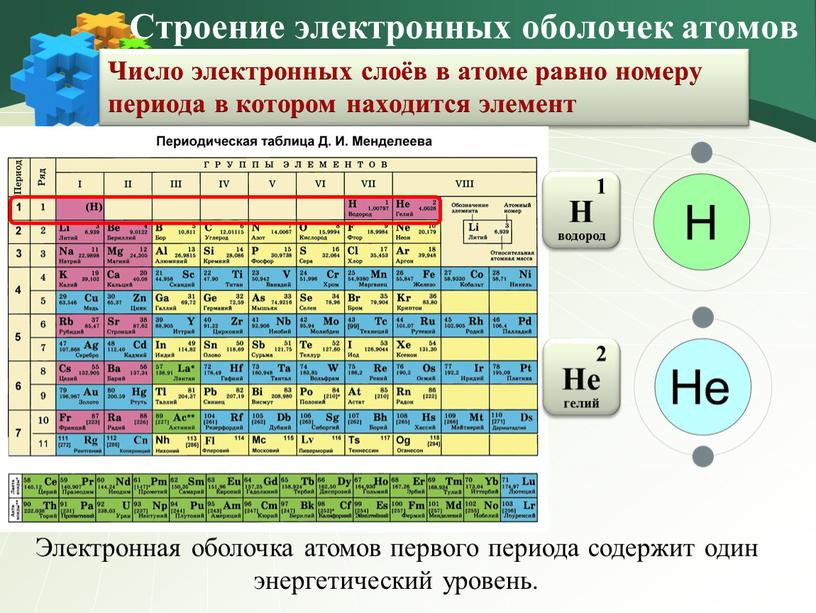
Что означает номер периода?
Элементы периодической таблицы принадлежат к группам и периодам. Группы периодической таблицы — это столбцы. Периоды периодической таблицы — это строки.
TL; DR (слишком долго; не читал)
Элементы одного периода имеют одно и то же главное квантовое число, которое описывает как размер, так и энергию внешней электронной оболочки атома.
Электронные оболочки
Электроны атома вращаются вокруг ядра в нечетком облаке, управляемое вероятностью.Однако может быть полезно думать об электронных орбитах как о жестких оболочках, содержащих множество различных возможных электронных орбиталей. По мере увеличения атомного номера атома его оболочки должны вмещать все большее количество электронов. Самая внешняя оболочка называется валентной оболочкой; номер периода относится к этой оболочке.
Самая внешняя оболочка называется валентной оболочкой; номер периода относится к этой оболочке.
Квантовые числа
Расположение электрона в атоме определяется квантовыми числами. Главное квантовое число n соответствует размеру и энергии электронных оболочек.Он может иметь ненулевые целочисленные значения: 1, 2, 3 и так далее. По мере увеличения числа увеличиваются и размер, и энергия электронной оболочки. Второе квантовое число l соответствует форме орбиталей внутри оболочки. Эти числа обычно обозначаются соответствующими буквами: 0 = s, 1 = p, 2 = d и 3 = f. Значение l может находиться в диапазоне от нуля до n-1. Например, если электрон имеет главное квантовое число 2, он может существовать в одной из двух разных орбитальных форм, s или p. Третье квантовое число m соответствует ориентации орбиталей.Третье квантовое число всегда должно быть между -l и + l. Следовательно, есть одна s-орбиталь, три p-орбитали, пять d-орбиталей и семь f-орбиталей.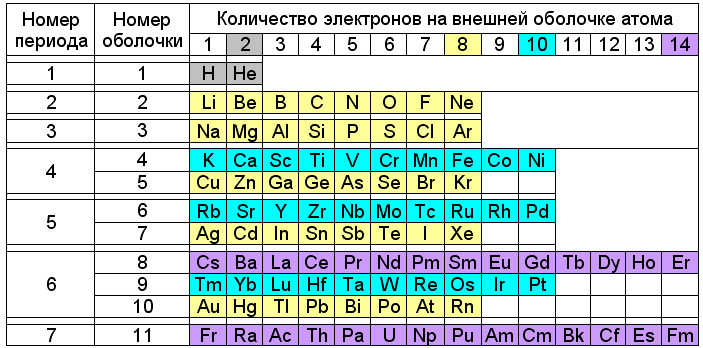
Добавление электронов и перемещение по периодической таблице
Одна пара электронов заполняет орбиталь. Водород имеет один электрон, поэтому он занимает первую орбиталь: 1 с. Гелий имеет два электрона, оба из которых все еще находятся на орбитали 1s. Следующий элемент, литий, имеет три электрона. Первые два подходят на орбите 1с.Однако третий электрон должен находиться на новой орбитали. Главное квантовое число 1 ограничивает второе квантовое число до нуля, что, в свою очередь, означает, что третье также должно быть нулевым. Следовательно, все пространство, связанное с первой оболочкой, занято. Следующий электрон должен существовать в новой оболочке и орбитали: 2s-орбитали. Это означает, что главное квантовое число увеличилось; элемент должен быть в другой период. Как и ожидалось, литий начинает группу 2 периодической таблицы, поскольку его валентная оболочка имеет главное квантовое число 2.
Тенденции атомного радиуса
Атомы не изменяют основные квантовые числа при перемещении слева направо по периодической таблице. Следовательно, все электроны существуют примерно на одинаковом расстоянии от ядра. Однако добавляется больше протонов. Это создает больший положительный заряд в ядре, что приводит к большему притяжению электронов внутрь. Следовательно, атомный радиус или расстояние от ядра до внешнего края атома фактически уменьшается по мере того, как вы перемещаетесь через период.С другой стороны, по мере продвижения вниз по таблице Менделеева номер периода увеличивается. Главное квантовое число увеличивается, и, следовательно, электронное облако увеличивается в размерах. В свою очередь, атомный радиус увеличивается по мере движения вниз по таблице Менделеева.
Следовательно, все электроны существуют примерно на одинаковом расстоянии от ядра. Однако добавляется больше протонов. Это создает больший положительный заряд в ядре, что приводит к большему притяжению электронов внутрь. Следовательно, атомный радиус или расстояние от ядра до внешнего края атома фактически уменьшается по мере того, как вы перемещаетесь через период.С другой стороны, по мере продвижения вниз по таблице Менделеева номер периода увеличивается. Главное квантовое число увеличивается, и, следовательно, электронное облако увеличивается в размерах. В свою очередь, атомный радиус увеличивается по мере движения вниз по таблице Менделеева.
Положение таблицы Менделеева и электронная конфигурация
Цель обучения
- Используйте периодическую таблицу для определения свойств атомов, таких как группы и электронные конфигурации.
Ключевые моменты
- Элементы упорядочены по периоду и группе, причем период соответствует основному уровню энергии, а группа — степени заполнения подоболочек.

- Свойства атома напрямую связаны с количеством электронов на различных орбиталях, и периодическая таблица очень похожа на дорожную карту для этих орбиталей, так что химические свойства могут быть выведены по положению элемента на столе.
- Электроны во внешней или валентной оболочке особенно важны, потому что они могут участвовать в совместном использовании и обмене, который отвечает за химические реакции.
Условия
- квантовое число Одно из определенных целых или полуцелых чисел, которые определяют состояние квантово-механической системы (например, электрона в атоме).
- электронная оболочка: Коллективные состояния всех электронов в атоме с одинаковым главным квантовым числом (визуализируются как орбита, по которой движутся электроны).
- — спецификация энергии и плотности вероятности электрона в любой точке атома или молекулы.
Орбитальная
Основные разделы периодической таблицы
Периодическая таблица представляет собой табличное отображение химических элементов, организованных на основе их атомных номеров, электронных конфигураций и химических свойств. Элементы представлены в возрастающем атомном номере. Основная часть таблицы представляет собой сетку 18 × 7. Элементы с одинаковым числом валентных электронов хранятся вместе в группах, таких как галогены и благородные газы. Есть четыре различных прямоугольных области или блока. F-блок обычно не включается в основную таблицу, а размещается ниже, так как встроенный f-блок часто делает таблицу непрактично широкой. Используя периодические тенденции, таблица Менделеева может помочь предсказать свойства различных элементов и отношения между свойствами.Таким образом, он обеспечивает полезную основу для анализа химического поведения и широко используется в химии и других науках.
Элементы представлены в возрастающем атомном номере. Основная часть таблицы представляет собой сетку 18 × 7. Элементы с одинаковым числом валентных электронов хранятся вместе в группах, таких как галогены и благородные газы. Есть четыре различных прямоугольных области или блока. F-блок обычно не включается в основную таблицу, а размещается ниже, так как встроенный f-блок часто делает таблицу непрактично широкой. Используя периодические тенденции, таблица Менделеева может помочь предсказать свойства различных элементов и отношения между свойствами.Таким образом, он обеспечивает полезную основу для анализа химического поведения и широко используется в химии и других науках.
Атомные орбитали
Электроны в частично заполненной самой внешней оболочке (или оболочках) определяют химические свойства атома; ее называют валентной оболочкой. Каждая оболочка состоит из одной или нескольких подоболочек, а каждая подоболочка состоит из одной или нескольких атомных орбиталей.
Свойства атома в конечном итоге зависят от числа электронов на различных орбиталях и от заряда ядра, который определяет компактность орбиталей. Чтобы связать свойства элементов с их расположением в периодической таблице, часто удобно использовать упрощенный вид атома, в котором ядро окружено одной или несколькими концентрическими сферическими «оболочками», каждая из которых состоит из орбиталей с наивысшим главным квантовым числом, содержащих по крайней мере один электрон; это s- и p-орбитали и могут включать d- или f-орбитали, которые зависят от атома. Модель оболочки, как и любая научная модель, — это не столько описание мира, сколько упрощенный взгляд на него, который помогает нам понимать и соотносить различные явления.
Чтобы связать свойства элементов с их расположением в периодической таблице, часто удобно использовать упрощенный вид атома, в котором ядро окружено одной или несколькими концентрическими сферическими «оболочками», каждая из которых состоит из орбиталей с наивысшим главным квантовым числом, содержащих по крайней мере один электрон; это s- и p-орбитали и могут включать d- или f-орбитали, которые зависят от атома. Модель оболочки, как и любая научная модель, — это не столько описание мира, сколько упрощенный взгляд на него, который помогает нам понимать и соотносить различные явления.
Мы рассмотрим несколько визуализаций таблицы Менделеева. Однако сначала было бы поучительно посмотреть, как это построено с логической точки зрения. Таблица сегодня является результатом непрерывных усилий более чем 100 лет наблюдений, измерений, предсказаний и доказательств взаимосвязи химических и физических явлений с конфигурациями и зарядами электронов.
Периоды 1, 2 и 3
Начиная с простых элементов, первые три строки периодической таблицы, называемые периодами 1, 2 и 3, соответствуют уровням n = 1, n = 2 и n = 3.
Конфигурации электронных оболочек первых 18 элементов Конфигурации электронных оболочек первых 18 элементов периодической таблицы. Соответствующие уровни энергии (n) указаны зелеными цифрами слева. Число электронов внешней оболочки представлено крайней правой цифрой в номерах групп.
Водород имеет 1 электрон на уровне 1s, а справа, гелий в Группе 18, имеет 2 электрона на уровне 1s, полностью заполненная оболочка, правило дуэта. Гелий — первый из благородных газов.Переходя к периоду 2, литий является первым элементом в строке с заполненной конфигурацией единиц. В течение периода сначала заполняются 2s, а затем 2p орбитали, достигая конфигурации для неона, следуя правилу октетов. Период 3 следует аналогичной схеме. Обратите внимание, что количество электронов на внешней оболочке является основным фактором, определяющим валентность элемента.
Конфигурации электронных оболочек элементов Положение в периодической таблице на основе конфигурации электронных оболочек. На этом изображении показана вся таблица Менделеева с диаграммами атомов и электронных оболочек, заполняемых движением по таблице. На этом изображении численно показана электронная конфигурация, показывающая населенность электронов в каждой подоболочке, начиная каждый период с полностью заполненного благородного газа.
На этом изображении показана вся таблица Менделеева с диаграммами атомов и электронных оболочек, заполняемых движением по таблице. На этом изображении численно показана электронная конфигурация, показывающая населенность электронов в каждой подоболочке, начиная каждый период с полностью заполненного благородного газа.
Периодическая таблица с отображением электронных оболочек. Элементы в этой таблице расположены в стандартной конфигурации периодов и групп. Каждый блок включает представление структуры электронной оболочки элемента.
Показать источники
Boundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета. Этот конкретный ресурс использовал следующие источники:
Периодическая таблица элементов | Химия
В 1869 году русский химик Дмитрий Менделеев впервые предположил, что химические элементы обладают «периодичностью свойств».
Менделеев пытался организовать химические элементы в соответствии с их атомным весом, предполагая, что свойства элементов будут постепенно меняться по мере увеличения атомного веса. Однако он обнаружил, что химические и физические свойства
Однако он обнаружил, что химические и физические свойства
элементы постепенно увеличивались, а затем внезапно менялись на разных
шаги или периоды. Чтобы учесть эти повторяющиеся тенденции, Менделеев сгруппировал элементы в таблице, содержащей как строки, так и столбцы.
Периодическая таблица элементов
Расположение современной таблицы Менделеева
Современная периодическая таблица элементов основана на наблюдениях Менделеева; однако, вместо того, чтобы быть организованной по атомному весу, современная таблица организована по атомному номеру (z).При перемещении слева направо по строке периодической таблицы свойства элементов постепенно меняются. В конце каждого ряда происходит резкое изменение химических свойств. Следующий элемент в порядке атомного номера более похож (химически говоря) на первый элемент в строке над ним; таким образом, новая строка
начинается на столе.
Например, кислород (O), фтор (F) и неон (Ne) (z = 8, 9 и 10 соответственно) — все это стабильные неметаллы, которые при комнатной температуре являются газами.Натрий (Na, z = 11), однако, представляет собой металлическое серебро, твердое при комнатной температуре, как и элемент литий (z = 3). Таким образом, натрий начинает новую строку в периодической таблице и помещается непосредственно под литием, подчеркивая их химический состав.
сходства.
Строки в периодической таблице называются периодами. Как один
движется слева направо в заданный период, химические свойства элементов медленно меняются. Столбцы в периодической таблице называются группами.Элементы в данной группе в периодической таблице имеют много схожих химических и физических свойств.
Контрольная точка понимания
Почему натрий стоит прямо под литием в периодической таблице?
Электронная конфигурация и таблица
«Периодическая» природа химических свойств, которые открыл Менделеев, связана с электронной конфигурацией атомов элементов. Другими словами, способ, которым электроны атома расположены вокруг его ядра, влияет на свойства атома.
Другими словами, способ, которым электроны атома расположены вокруг его ядра, влияет на свойства атома.
Теория атома Нильса Бора говорит нам, что электроны не
расположены случайным образом вокруг ядра атома, но встречаются в определенных электронных оболочках (см. наш модуль Atomic Theory II для получения дополнительной информации). Каждая оболочка имеет ограниченную емкость для электронов. По мере заполнения нижних оболочек дополнительные электроны находятся в более удаленных оболочках.
Емкость первой электронной оболочки составляет два электрона, а второй — восемь. Таким образом, в нашем примере, рассмотренном выше, кислород с восемью протонами и восемью электронами несет два электрона в своей первой оболочке и шесть — во второй. Фтор с девятью электронами несет два в своей первой оболочке и семь во второй. Неон с десятью электронами несет два в первом и восемь во втором.Поскольку количество электронов во второй оболочке увеличивается, мы можем представить, почему химические свойства постепенно меняются, когда мы переходим от кислорода к фтору и неону.
У натрия одиннадцать электронов. Двое поместились в его первую оболочку, но
помните, что вторая оболочка может нести только восемь электронов.
Одиннадцатый электрон натрия не может поместиться ни в его первую, ни в вторую оболочку. Этот электрон поселяется на еще одной орбите, третьей электронной оболочке натрия.Причина резкого изменения химических свойств при переходе от неона к натрию заключается в том, что между двумя элементами происходит резкий сдвиг в электронной конфигурации. Но почему натрий похож на литий? Давайте посмотрим на электронные конфигурации этих элементов.
Электронные конфигурации для выбранных элементов
Как вы можете видеть на иллюстрации, в то время как у натрия есть три электронные оболочки, а у лития две, их общая характеристика заключается в том, что у них обоих есть только один электрон на крайнем внешнем
электронная оболочка.Эти электроны внешней оболочки (называемые валентными
электроны) важны для определения химических свойств элементов.
Химические свойства элемента определяются тем, как его атомы взаимодействуют с другими атомами. Если мы изобразим внешнюю (валентную) электронную оболочку атома как сферу, охватывающую все внутри, то только валентная оболочка может взаимодействовать с другими атомами — почти так же, как это только краска на внешней стороне вашего дома. который «взаимодействует» с, и
промокает, дождевая вода.
Валентная оболочка атома «покрывает» внутренние электронные оболочки
Электроны валентной оболочки в атоме определяют способ его взаимодействия с соседними атомами и, следовательно, определяют его химические свойства. Поскольку и натрий, и литий имеют один валентный электрон, они обладают схожими химическими свойствами.
Контрольная точка понимания
Химические свойства элемента определяются количеством электронов в
Сокращение электронной конфигурации
Для элементов в группах, обозначенных A в периодической таблице (IA, IIA и т. Д.) количество валентных электронов соответствует номеру группы. Таким образом, Li, Na и другие элементы в группе IA имеют один валентный электрон. Be, Mg и другие элементы группы IIA имеют два валентных электрона. B, Al и другие элементы группы IIIA имеют три валентных электрона и так далее. Номер строки или периода, в котором находится элемент в таблице, равен количеству полных оболочек, содержащих электроны в атоме. H и He в первом периоде обычно имеют электроны только в первой оболочке; Li, Be, B и другие элементы периода два занимают две оболочки и так далее.Чтобы записать электронную конфигурацию элементов, ученые часто используют стенографию, в которой за символом элемента следуют его электронные оболочки. Ниже приведены несколько примеров.
Д.) количество валентных электронов соответствует номеру группы. Таким образом, Li, Na и другие элементы в группе IA имеют один валентный электрон. Be, Mg и другие элементы группы IIA имеют два валентных электрона. B, Al и другие элементы группы IIIA имеют три валентных электрона и так далее. Номер строки или периода, в котором находится элемент в таблице, равен количеству полных оболочек, содержащих электроны в атоме. H и He в первом периоде обычно имеют электроны только в первой оболочке; Li, Be, B и другие элементы периода два занимают две оболочки и так далее.Чтобы записать электронную конфигурацию элементов, ученые часто используют стенографию, в которой за символом элемента следуют его электронные оболочки. Ниже приведены несколько примеров.
| Сокращение конфигурации элемента | ||||
|---|---|---|---|---|
| Элемент | Сокращение конфигурации | |||
| Водород | H | 1e — | ||
| Литий | Ли | 2e — | 1e — | |
| Фтор | F | 2e — | 7e — | |
| Натрий | Na | 2e — | 8e — | 1e — |
Для получения дополнительных сведений в таблице, приведенной ниже, показаны электронные конфигурации первых одиннадцати элементов.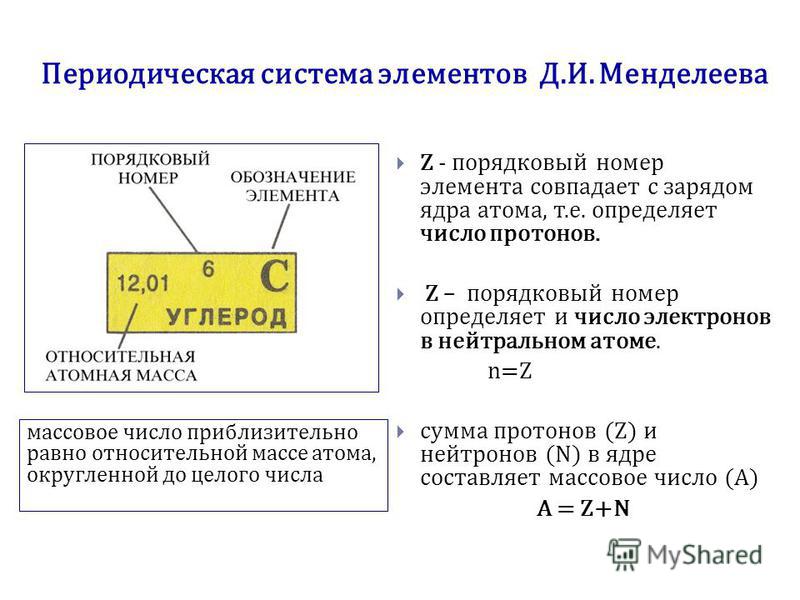
Резюме
Современная таблица Менделеева основана на наблюдениях Дмитрия Менделеева 1896 года о том, что химические элементы можно сгруппировать по химическим свойствам, которые они проявляют. Этот модуль объясняет расположение элементов в таблице периодов. Он определяет периоды и группы и описывает, как различные электронные конфигурации влияют на свойства атома.
Что означают числа в таблице Менделеева
Вас смущают все числа в таблице Менделеева? Вот что они означают и где найти важные элементы.
Атомный номер элемента
Одно число, которое вы найдете во всех периодических таблицах, — это атомный номер каждого элемента. Это количество протонов в элементе, которое определяет его идентичность.
Как это определить: Не существует стандартного макета для ячейки элемента, поэтому вам необходимо определить расположение каждого важного числа для конкретной таблицы. Атомный номер прост, потому что это целое число, которое увеличивается при перемещении слева направо по таблице.Самый низкий атомный номер — 1 (водород), а самый высокий атомный номер — 118.
Атомный номер прост, потому что это целое число, которое увеличивается при перемещении слева направо по таблице.Самый низкий атомный номер — 1 (водород), а самый высокий атомный номер — 118.
Примеры: Атомный номер первого элемента, водорода, равен 1. Атомный номер меди равен 29.
Атомная масса или атомный вес элемента
Большинство периодических таблиц включают значение атомной массы (также называемой атомным весом) на каждом элементе плитки. Для одного атома элемента это будет целое число, сложив вместе количество протонов, нейтронов и электронов для атома.Однако значение, указанное в периодической таблице, представляет собой среднее значение массы всех изотопов данного элемента. Хотя количество электронов не вносит значительный вклад в массу атома, изотопы имеют разное количество нейтронов, которые влияют на массу.
Как идентифицировать: Атомная масса — десятичное число. Количество значащих цифр варьируется от таблицы к таблице. Обычно значения перечисляются с двумя или четырьмя десятичными знаками. Кроме того, атомная масса время от времени пересчитывается, поэтому это значение может незначительно изменяться для элементов в последней таблице по сравнению с более старой версией.
Обычно значения перечисляются с двумя или четырьмя десятичными знаками. Кроме того, атомная масса время от времени пересчитывается, поэтому это значение может незначительно изменяться для элементов в последней таблице по сравнению с более старой версией.
Примеры: Атомная масса водорода равна 1,01 или 1,0079. Атомная масса никеля 58,69 или 58,6934.
Группа элементов
Многие периодические таблицы содержат номера групп элементов, которые являются столбцами периодической таблицы. Элементы в группе имеют одинаковое количество валентных электронов и, таким образом, имеют много общих химических и физических свойств. Однако не всегда существовал стандартный метод нумерации групп, поэтому это может сбивать с толку при просмотре старых таблиц.
Как это определить: Номер группы элементов указан над верхним элементом каждого столбца. Значения группы элементов представляют собой целые числа от 1 до 18.
Примеры: Водород принадлежит к группе элементов 1. Бериллий является первым элементом группы 2. Гелий является первым элементом группы 18.
Бериллий является первым элементом группы 2. Гелий является первым элементом группы 18.
Период элемента
Строки периодической таблицы называются периодами. В большинстве периодических таблиц их не нумеруют, потому что они довольно очевидны, но в некоторых таблицах они есть.Период указывает на самый высокий уровень энергии, достигнутый электронами атома элемента в основном состоянии.
Как это определить: Номера периодов расположены в левой части таблицы. Это простые целые числа.
Примеры: Строка, начинающаяся с водорода, равна 1. Строка, начинающаяся с лития, равна 2.
Электронная конфигурация
Некоторые периодические таблицы перечисляют электронную конфигурацию атома элемента, обычно записанную в сокращенной записи для экономии места.В большинстве таблиц это значение отсутствует, поскольку оно занимает много места.
Как это определить: Это не простое число, но включает орбитали.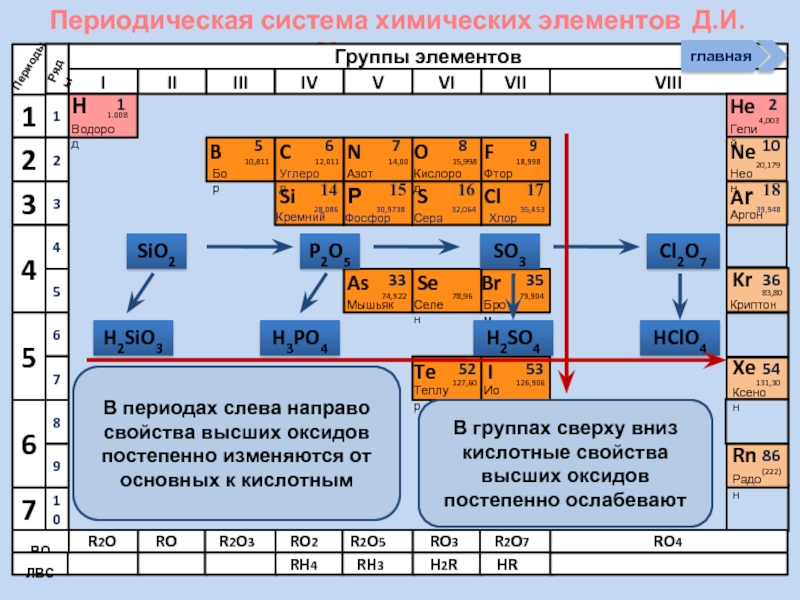
Примеры: Электронная конфигурация для водорода — 1s 1 .
Другая информация о Периодической таблице
Таблица Менделеева помимо чисел включает и другую информацию. Теперь, когда вы знаете, что означают числа, вы можете узнать, как прогнозировать периодичность свойств элемента и как использовать периодическую таблицу в расчетах.
Chem4Kids.com: Элементы и Периодическая таблица: Периодическая таблица
Периодическая таблица организована в виде большой сетки. Каждый элемент размещается в определенном месте из-за его атомной структуры. Как и в любой другой сетке, в периодической таблице есть строки (слева направо) и столбцы (вверх и вниз). Каждая строка и столбец имеют определенные характеристики. Например, магний (Mg) и кальций (Mg) находятся во втором столбце и имеют определенные сходства, в то время как калий (K) и кальций (Ca) из четвертой строки имеют разные характеристики. Магний и натрий (Na) также имеют общие качества, потому что находятся в один период (схожие электронные конфигурации).
Магний и натрий (Na) также имеют общие качества, потому что находятся в один период (схожие электронные конфигурации).
Несмотря на то, что они пропускают некоторые квадраты между ними, все строки читаются слева направо. Когда вы смотрите на таблицу Менделеева, каждая строка называется периодом (Понять? Как таблица PERIODic.). Все элементы периода имеют одинаковое количество атомных орбиталей. Например, каждый элемент в верхнем ряду (первый период) имеет одну орбиталь для своих электронов. Все элементы во втором ряду (второй период) имеют две орбитали для своих электронов.По мере движения вниз по таблице каждая строка добавляет орбиталь. В настоящее время существует максимум семь электронных орбиталей.
Теперь вы знаете, что месячные идут слева направо. Периодическая таблица Менделеева также имеет особое название для своих вертикальных столбцов. Каждый столбец называется группой . Элементы в каждой группе имеют одинаковое количество электронов на внешней орбитали . Эти внешние электроны также называются валентными электронами . Это электроны, участвующие в химических связях с другими элементами.
Эти внешние электроны также называются валентными электронами . Это электроны, участвующие в химических связях с другими элементами.
Каждый элемент в первом столбце (первая группа) имеет один электрон во внешней оболочке. Каждый элемент во втором столбце (вторая группа) имеет два электрона во внешней оболочке. Продолжая считать столбцы, вы будете знать, сколько электронов находится во внешней оболочке. Когда вы смотрите на элементы перехода, есть исключения из порядка, но вы понимаете общую идею. Переходные элементы добавляют электроны на предпоследнюю орбиталь.
Например, азот (N) имеет атомный номер семь.Атомный номер говорит о том, что в нейтральном атоме азота семь электронов. Сколько электронов находится на его внешней орбитали? Азот находится в пятнадцатом столбце, обозначенном «Группа VA». «V» — это римская цифра для пяти, обозначающая количество электронов на внешней орбитали. Вся эта информация говорит вам, что на первой орбитали есть два электрона, а на второй — пять (2-5).
Фосфор (P) также находится в группе VA, что означает, что он также имеет пять электронов на своей внешней орбитали.Однако, поскольку атомный номер фосфора равен пятнадцати, электронная конфигурация составляет 2-8-5.
Водород (H) и гелий (He) — особые элементы. Водород в нейтральной форме не имеет нейтрона. Есть только один электрон и один протон. Вы, вероятно, не найдете атомарных водородов, плавающих сами по себе. Атомарный водород хочет объединиться с другими элементами, чтобы заполнить свою внешнюю оболочку. Ваша химическая работа, скорее всего, будет использовать молекулярный водород (H 2 ) или ионы водорода (H + , протоны).
Гелий (He) отличается от всех других элементов. Он очень стабилен, поскольку на его внешней орбитали (валентной оболочке) всего два электрона. Несмотря на то, что у него всего два электрона, он все еще сгруппирован с благородными газами, у которых есть восемь электронов на внешних орбиталях. Благородные газы и гелий «счастливы», потому что их валентная оболочка заполнена. {2} \)
{2} \)
Атомный радиус
Уменьшается за период.
Первая энергия ионизации
Увеличивается с течением времени.
Электроотрицательность
Увеличивается за период.
Температура плавления и кипения
Повышается до углерода, а затем понижается до неона.
Электропроводность
Увеличивается до бора, а затем уменьшается.{20} \ text {Ne} \)
Хлориды
\ (\ text {NCl} _ {3} \)
без соединений, но кислород соединяется с хлором в соединения, называемые оксидами хлора
без соединений
без соединений
Оксиды
\ (\ text {NO} _ {2} \) или \ (\ text {NO} \)
Соединений нет. Кислород соединяется с самим собой, образуя \ (\ text {O} _ {2} \).{6} \)
Кислород соединяется с самим собой, образуя \ (\ text {O} _ {2} \).{6} \)
Атомный радиус
Уменьшается за период.
Первая энергия ионизации
Увеличивается с течением времени.
Электроотрицательность
Увеличивается за период.
Температура плавления и кипения
Повышается до углерода, а затем понижается до неона.{-1} $} \)) и атомный номер (Z) для ряда элементов периодической таблицы:
Z | Название элемента | Энергия ионизации | Z | 03 | ||||||||||
1 | 1310 | 10 | 2072 | |||||||||||
2 | 23602 | 23602 | 3 | 517 | 12 | 734 | ||||||||
4 | 895 | 895 | 895 | 5 | 797 90 003 | 14 | 783 | |||||||
6 | 1087 | 15 | 1051 | 16 | 994 | |||||||||
8 | 1307 | 17 | 17 | 1250 | 1250 | 1540 | ||||||||
Введите названия элементов.

Нарисуйте линейный график, чтобы показать взаимосвязь между атомным номером (по оси x) и энергией ионизации (по оси y).
Опишите любые тенденции, которые вы наблюдаете.
Объясните, почему:
энергия ионизации для \ (Z = 2 \) выше, чем для \ (Z = 1 \)
энергия ионизации для \ (Z = 3 \) ниже, чем для \ (Z = 2 \)
энергия ионизации увеличивается между \ (Z = 5 \) и \ (Z = 7 \)
Решение пока недоступно.
Что такое валентные электроны и как их найти? Где они расположены?
Валентные электроны — это те электроны, которые находятся во внешней оболочке, окружающей атомное ядро.
Валентные электроны имеют решающее значение, потому что они дают глубокое понимание химических свойств элемента: является ли он электроотрицательным или электроположительным по природе, или они указывают порядок связи химического соединения — количество связей, которые могут быть образованы между двумя атомами.
Поскольку ковалентные связи образуются за счет совместного использования электронов, присутствующих в конечной оболочке, число указывает, сколько связей разрешено образовывать.
Что такое валентные электроны?
Валентные электроны — это те электроны, которые находятся во внешней оболочке атома. Другими словами, это электроны, которые могут быть получены или потеряны в ходе химической реакции.
Где находятся валентные электроны?
Независимо от типа химической связи, образованной между атомами, будь то ионная, ковалентная или металлическая связь, изменения в атомной структуре ограничиваются электронами во внешней оболочке, т. е.е. валентные электроны.
е.е. валентные электроны.
Самый простой метод — это сослаться на атомную конфигурацию элемента и просто подсчитать количество электронов в самой внешней оболочке. Однако это было бы чрезвычайно утомительной работой, поскольку нам, возможно, придется рыться в учебниках, чтобы найти конфигурации, с которыми мы не знакомы.
Однако не стоит беспокоиться, так как есть гораздо более простой способ определения этого желанного числа. Это более общий подход, который требует всего лишь одного маленького великолепного прямоугольного листа бумаги — таблицы Менделеева.
Чтобы узнать количество валентных электронов элемента, мы должны только обратиться к периодической таблице и найти положение элемента в ней.
Валентные электроны и Периодическая таблица
Периодическая таблица представляет собой аккуратное расположение всех элементов, которые мы обнаружили на данный момент. Элементы расположены слева направо в порядке возрастания их атомных номеров или количества протонов или электронов, которые они содержат.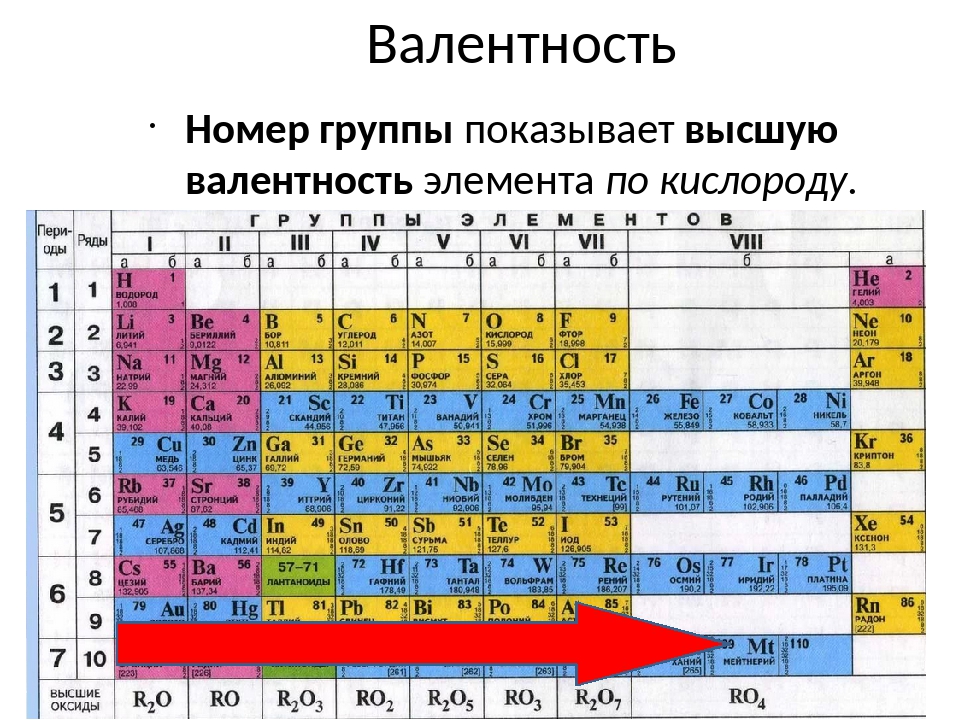
Элементы делятся на четыре категории: элементы основной группы, переходные элементы, лантаноиды и актиниды.Последние два также известны как внутренние переходные элементы .
Таблица содержит всего 18 столбцов, формально известных как групп, , а также строки, формально известные как периодов. В подтаблице вверху 7 рядов, а внизу — 2 ряда. Переходные элементы образуют мост или закрепляют переход между элементами 2-й и 13-й групп.
Как найти валентные электроны?
По мере того, как мы движемся по группе вниз, количество валентных электронов остается неизменным, даже если количество оболочек увеличивается.
В то время как валентные электроны за период постепенно поднимаются на единицу, количество оболочек остается неизменным. Номер периода (номер строки, чтобы напомнить вам), в котором можно найти элемент, указывает количество оболочек, окружающих его ядро.
Итак, какое значение имеет номер группы?
Валентные электроны элементов , кроме переходных элементов — элементы основной группы
В то время как номер периода указывает количество оболочек, номер группы указывает количество валентных электронов во внешней оболочке. В частности, число в разряде единиц. Однако это верно только для основных элементов группы — элементов, населяющих группы 1-2 и 13-18.
В частности, число в разряде единиц. Однако это верно только для основных элементов группы — элементов, населяющих группы 1-2 и 13-18.
Правило неприменимо к элементам перехода и внутренним элементам перехода (мы рассмотрим эту причину через минуту). Например, натрий (Na) находится в периоде 3, группе 1, что означает, что он имеет 3 оболочки и один электрон в валентной оболочке.
Или, вы можете рассмотреть хлор в Группе 17. Соответственно, чтобы определить его валентные электроны, мы должны искать только число вместо единиц: 7.Как и ожидалось, это именно количество электронов в его валентной оболочке.
Этот метод простого обращения к периодической таблице и определения соответствующего номера группы устранил проблемы и сложности, которые когда-то сопровождали трудоемкий поиск индивидуальных атомных конфигураций.
А как насчет валентных электронов элементов между ними? Очевидно, мы не можем забыть о лантаноидах и актинидах…
Краткое объяснение того, как оболочки заполняются электронами
Переходные элементы мало чем отличаются от металлов, которые идут плечом к плечу в элементах основной группы. Они очень похожи на металлы: они пластичны, пластичны и могут проводить как тепло, так и электричество. Тот факт, что два лучших проводника — медь (Cu) и алюминий (Al) — являются переходными металлами, показывает, насколько их свойства перекрываются.
Они очень похожи на металлы: они пластичны, пластичны и могут проводить как тепло, так и электричество. Тот факт, что два лучших проводника — медь (Cu) и алюминий (Al) — являются переходными металлами, показывает, насколько их свойства перекрываются.
Однако они не дублируют результаты, полученные нами с помощью описанного выше метода. Нельзя перечислить их валентные электроны, просто сославшись на номер их группы. Это сводится к тому, как электроны занимают оболочки в переходных элементах.
Чтобы понять это исключение, мы должны понять, как электроны занимают оболочки в любом элементе .
Однако для начала мы должны отучиться от школьного метода заполнения оболочек вокруг атомного ядра: помните 2..8..8..18 и так далее? Что ж, есть причина, по которой мы распределяем электроны именно таким образом.
Аналогия с солнечной системой, описывающая расположение электронов вокруг атома, полностью ложна. Его следует немедленно исключить, но поскольку это облегчает трудность, которая сопровождает выставку фактической модели , учебники для средних школ в первую очередь полагаются на это элементарное объяснение.
Электроны не занимают твердые оболочки вокруг своего ядра. На самом деле их расположение вокруг ядра весьма неопределенно. Они могут занимать только определенные энергетические уровни вокруг ядра. Это наиболее вероятных , которые можно найти там. Уровни технически известны как квантовые состояния и обозначаются так называемыми квантовыми числами (n).
Теперь следующее предложение может показаться лицемерным, но квантовые числа можно рассматривать как старые добрые оболочки, но теперь с подоболочками, которые технически известны как орбитали (s, p, d, f).Несмотря на это упрощение, он вполне подходит для ускоренного курса, подобного этому.
Существует правило, ограничивающее количество электронов, которое может вместить суб-оболочка: s-2, p-6, d-10 и f-14. Если этого было недостаточно, добавляя к бреду, оболочки можно заполнять только в определенном порядке, указанном ниже. Назовем это правилом правилом .
Электроны должны заполняться слева направо только в этом точном порядке.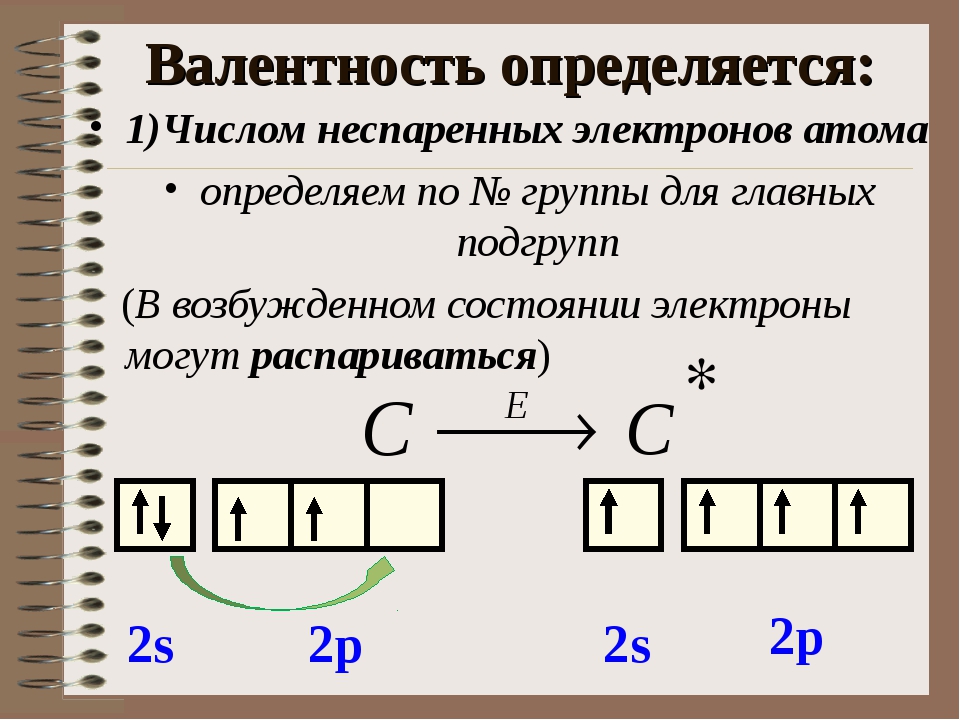
Если бы мы бессознательно распределили электроны относительно того, как выстроены суб-оболочки, как показано на рисунке выше, кальций (Ca) с атомным номером 20 имел бы конфигурацию 2,8,10 (2, 2+ 6, 2 + 6 + 2).Любой школьный учебник химии скажет вам, что это неверно, так как точная конфигурация — 2,8,8,2.
Однако, поскольку мы должны соблюдать правило , мы наблюдаем, что 4 должны быть заполнены перед 3d, так, что теперь 8 в 3-й оболочке и 2 в 4-й, что составляет конфигурацию: 2,8,8 , 2. Вуаля! Как весело воскликнул бы Ричард Фейнман: «Удовольствие узнавать все! К сожалению, радость прожита наполовину — причина правила , эта кажущаяся абсурдность выходит за рамки данной статьи.
Хорошо, теперь, когда мы знаем, как заполняются оболочки, мы можем двигаться дальше, чтобы найти количество валентных электронов в переходных элементах.
Валентные электроны лантаноидов и актинидов (переходные и внутренние переходные элементы)
Рассмотрим скандий (Sc) с его атомным номером 21. Заполняя электроны в соответствии с нашим правилом , , мы видим, что 21-й электрон занимает 3d-суб- оболочка. Однако, поскольку ранее заполненная 4-я оболочка (4s) имеет 2 электрона и, по-видимому, является самой внешней оболочкой, количество валентных электронов равно 2.
Заполняя электроны в соответствии с нашим правилом , , мы видим, что 21-й электрон занимает 3d-суб- оболочка. Однако, поскольку ранее заполненная 4-я оболочка (4s) имеет 2 электрона и, по-видимому, является самой внешней оболочкой, количество валентных электронов равно 2.
Аналогично, каждый переходный элемент в 4-м периоде должен иметь 2 валентных электрона. Причина в том, что хотя 3d заполняется раньше, чем 4s, два электрона, расположенные в 4-й оболочке, являются обитателями самой внешней оболочки и по праву заслуживают обозначения валентных электронов.
Фактически, это верно для переходных элементов в каждый период. Рассмотрим Золото (Au), расположенное в 6 периоде (строке) и 11 группе (столбце). В процессе наполнения его раковин можно понять, что после начинки 5d следует начинка 6s.А поскольку 6-я оболочка расположена выше 5-й, количество валентных электронов составляет… * барабанная дробь * … 2!
Однако именно так электроны в идеале выстроились бы в линию. Энергетические различия между этими оболочками ничтожны, и электроны (или Природа, если на то пошло) жаждут стабильности больше всего на свете. Электрон с радостью совершил бы прыжок на соседнюю оболочку с относительно эквивалентной энергией, чтобы достичь более стабильной конфигурации.
Энергетические различия между этими оболочками ничтожны, и электроны (или Природа, если на то пошло) жаждут стабильности больше всего на свете. Электрон с радостью совершил бы прыжок на соседнюю оболочку с относительно эквивалентной энергией, чтобы достичь более стабильной конфигурации.
Хорошим примером является непостоянная конфигурация атома меди (Cu).9. Для меди конфигурация немного тревожит — более стабильная конфигурация будет иметь 10 электронов в трехмерной оболочке, и это именно то, что мы наблюдаем! Поскольку энергии оболочек сравнимы, электрон из 4s совершает прыжок в 3d, чтобы выполнить стабильную конфигурацию. Количество валентных электронов теперь 1!
Ряд элементов среди переходных элементов демонстрируют эту странность. Это также наблюдается во внутренних переходных элементах из-за сравнимых уровней энергии оболочек f, d и s.Таким образом, , в заключение, количество валентных электронов для переходных и внутренних переходных элементов изменяется непредсказуемым образом.
 Степени окисления могут иметь положительное, отрицательное или нулевое значение, поэтому алгебраическая сумма степеней окисления элементов в молекуле с учётом числа их атомов равна 0, а в ионе – заряду иона.
Степени окисления могут иметь положительное, отрицательное или нулевое значение, поэтому алгебраическая сумма степеней окисления элементов в молекуле с учётом числа их атомов равна 0, а в ионе – заряду иона.
 е. высшая положительная степень окисления равна числу электронов на внешнем слое, которое соответствует номеру группы.
е. высшая положительная степень окисления равна числу электронов на внешнем слое, которое соответствует номеру группы. Степени окисления химических элементов по алфавиту.
Степени окисления химических элементов по алфавиту.
 Степени окисления химических элементов по номеру.
Степени окисления химических элементов по номеру.
 Максимальная и минимальная степень окисления. Возможные степени окисления химических элементов.
Максимальная и минимальная степень окисления. Возможные степени окисления химических элементов.



 Степени окисления химических элементов по номеру.
Степени окисления химических элементов по номеру.


 Валентные электроны имеют решающее значение, потому что они дают глубокое понимание химических свойств элемента: является ли он электроотрицательным или электроположительным по природе, или они указывают порядок связи химического соединения — количество связей, которые могут быть образованы между двумя атомами.
Валентные электроны имеют решающее значение, потому что они дают глубокое понимание химических свойств элемента: является ли он электроотрицательным или электроположительным по природе, или они указывают порядок связи химического соединения — количество связей, которые могут быть образованы между двумя атомами.